課程內容
《開發利用金屬礦物和海水資源》
一、開發利用金屬礦物
金屬的存在有什么規律嗎?
少數化學性質不活潑的金屬,在自然界中能以游離態存在,如金和鉑以及少量的銀和銅,較活潑的鐵只能存在于隕石中,而化學性質活潑的金屬,在自然界中總是以化合態存在。但在實際生產和生活中應用的金屬材料卻往往是純金屬或合金,這就需要把金屬從金屬礦物中提煉出來,這就叫做金屬的冶煉。
思考:
1、金屬冶煉指什么?
2、為什么不同金屬的冶煉方法不同?
3、金屬活動順序與金屬冶煉有什么關系?
金屬冶煉的一般方法:
1、熱分解法——金屬活動性順序表中氫以后的金屬
2、熱還原法——大多數金屬(活動性介于Zn-Cu的金屬)
3、電解法——(鉀、鈣、鈉、鎂、鋁等活潑金屬的冶煉)
【實驗4-1】
鎂條的燃燒為鋁熱劑提供高溫條件,氯酸鉀為鎂條繼續燃燒提供氧。
鋁熱劑:金屬鋁與鎂、鈷、鎳、錳等的氧化物的混合物。
現象:鎂條激烈燃燒,發出白光,導致混合物激烈反應過后,有紅熱的鐵水生產。
鋁與氧化鐵反應的化學方程式:2Al+Fe2O3==(高溫)2Fe+Al2O3
金屬礦物資源有限合理利用礦物資源
途徑:提高金屬礦物的利用率
減少金屬的使用量
加強金屬資源的回收和再利用
使用其他材料代替金屬材料
二、海水資源
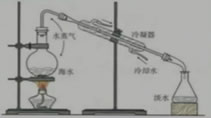
1、海水水資源的利用——海水淡化
海水蒸餾原理示意圖
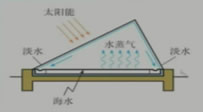
太陽能蒸發海水示意圖:
2、海水化學資源的開發利用
——海水提NaCl
【實驗4-2】如何證明海帶中存在碘元素
實驗現象:加入H2O2后,溶液由無色變為深黃色,加入淀粉溶液后,溶液又變為深藍色
化學方程式:2KI+H2O2+H2SO4=I2+K2SO4+2H2O
科學探究
將Br-轉變為Br2是海水提溴中關鍵的化學反應,你能否設計一個實驗方案模擬這一過程?寫出有關反應的化學方程式。
濃縮海水→(通Cl2)→溴單質→(通空氣、水蒸氣,SO2吸收)→氫溴酸→(通氯氣)→溴單質
2NaBr+Cl2=2NaCl+Br2
Br2+SO2+2H2O=2HBr+H2SO4
2HBr+Cl2=2HCl+Br2
此內容正在抓緊時間編輯中,請耐心等待
劉老師
男,中教高級職稱
工作勤奮,責任心強,多次被評為市優秀教師。