課程內容
《等效平衡》
學習目標:
1、理解和掌握等效平衡的概念
2、理解幾種類型的等效平衡及分析方法
3、提高分析問題和解決問題的能力
等效平衡
相同條件下,同一可逆反應體系,不管從正反應開始,還是從逆反應開始,達到平衡時,任何相同物質的百分含量(體積分數、質量分數或物質的量分數)都相同的化學平衡互稱等效平衡。
等效平衡的判斷方法
任何狀態的體系,都用“極端狀態”來比較,通過可逆反應的化學計量數換算成同一邊物質。
等效平衡建成條件探究一
恒溫恒容: 2SO2(g) + O2(g)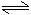 2SO3(g)
2SO3(g)
途徑1起始 2mol 1mol 0
途徑2起始 0 0 2mol
途徑3起始 1mol 0.5mol 1mol
(1+1)mol (0.5+0.5)mol 0
途徑4起始 0.5mol 0.25mol 1.5mol
途徑5起始 amol bmol cmol
【問題】①途徑2、3與1等效嗎?
②途徑4中O2(g)和SO3(g)的起始量為多少,到達平衡時可與途徑1等效?
③途徑5中a、b、c符合怎樣的關系達到平衡狀態時與途徑1等效?
恒溫恒容:等效平衡建成條件
結論:
恒溫恒容條件下,對于反應前后氣體分子數發生變化的可逆反應,若改變起始加入情況,通過可逆反應的化學計量數換算成同一邊物質的物質的量與原平衡起始加入量相同,則二者平衡等效。
等效平衡建成條件的探究二
恒溫恒容:等效平衡建成條件
結論:
恒溫恒容條件下對于反應前后氣體分子數不變的可逆反應,若改變起始加入情況,只要通過可逆反應的化學計量數換算成同一邊物質的物質的量之比與原平衡起始加入量相同,則二者平衡等效。
等效平衡建成條件的探究三
恒溫恒壓: 2SO2(g) + O2(g)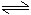 2SO3(g)
2SO3(g)
途徑1起始 2mol 1mol 0
途徑2起始 4mol 2mol 0
途徑1和2是否為等效平衡?
恒溫恒壓: H2(g) + I2(g)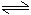 2HI(g)
2HI(g)
途徑1起始 2mol 1mol 0
途徑2起始 4mol 2mol 0
途徑1和2是否為等效平衡?
結論:
恒溫恒壓條件下若改變起始加入情況,只要通過可逆反應的化學計量數換算成同一邊物質的物質的量之比與起始加入量相同,則兩平衡等效。
等效平衡小結
條件
等效條件
結果
恒溫恒容(△n(g)≠0)
投料換算成相同物質表示時物質的量相同
兩平衡各組分百分含量均相同(n、c相同)
恒溫恒容(△n(g)=0)
投料換算成相同物質表示時物質的量成比例
兩平衡各組分百分含量相同(n、c按比例變化)
恒溫恒壓
投料換算成相同物質表示時物質的量成比例
兩平衡各組分百分含量相同(c相同,n按比例變化)
等效平衡問題總結:
等效平衡的條件
對mA(g)+nB(g)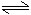 pC(g)+qD(g)
pC(g)+qD(g)
1、如果m+n≠p+q
恒溫恒容:相同起始物質的物質的量相等
恒溫恒壓:相同起始物質的物質的量之比相等
2、如果如果m+n=p+q
相同起始物質的物質的量之比相等
練習
在一恒容的容器中充入2mol A和1mol B,發生反應2A(g)+B(g)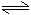 xC(g),達到平衡后,C的體積分數為W%。若維持容器中的容積和溫度不變,按起始物質的量:A為0.6mol,B為0.3mol,C為1.4mol充入容器,達到平衡后,C的體積分數仍為W%,則 x的值為( )
xC(g),達到平衡后,C的體積分數為W%。若維持容器中的容積和溫度不變,按起始物質的量:A為0.6mol,B為0.3mol,C為1.4mol充入容器,達到平衡后,C的體積分數仍為W%,則 x的值為( )
A、只能為2 B、只能為3 C.可能是2,也可能是3 D、無法確定
此內容正在抓緊時間編輯中,請耐心等待
李老師
女,中教中級職稱
熱愛教育,樂于教育,有高尚的師德,事業心強,治學嚴謹,教育教學成績顯著。




















