課程內容
《化學反應進行的方向》
自發過程:在一定條件下,不借助外部力量就能自動進行的過程。
自發反應:在一定條件下不需要外界幫助就能自動進行的反應,稱為自發反應。
問題與思考
自然界中水總是從高處往低處流;
電流總是從電位高的地方向電位低的地方流動;
室溫下冰塊自動融化;
墨水擴散;
食鹽溶解于水。
這些生活中的現象將向何方發展,我們非常清楚,因為它們有明顯的自發性——其中是否蘊藏了一定的科學原理?
能量由高到低
1、能量判據(焓判據)
日常生活中長期積累的經驗而總結得到一條經驗規律→能量判據(焓判據):體系趨向于從高能狀態轉變為低能狀態(這時體系會對外做功或者釋放熱量即△H<0)。
結論:△H<0有利于反應自發進行,但自發反應不一定要△H<0。
焓變只是反應能否自發進行的一個因素,但不是惟一因素。只根據焓變來判斷反應方向是不全面的。
2、熵判據
火柴散落過程混亂度如何變化?
從混亂度角度分析它們為什么可以自發?
【歸納與總結】
自發過程的體系趨向于由有序轉變為無序,導致體系的熵增大,這一經驗規律叫做熵增原理,也就是反應方向判斷的熵判據。
混亂度越大越穩定,△S>0有利于反應自發進行。
導致混亂度增加的一些因素
1、同一物質氣態時熵值最大,液態較小,固態時最小。
2、固體的溶解過程,墨水擴散過程和氣體擴散過程。
3、反應過程中氣體物質的量增加的反應。
自發反應一定是熵增加的反應嗎?
結論:△S>0有利于反應自發進行,自發反應不一定要△S>0。
要正確判斷一個化學反應能否自發進行,必須綜合考慮反應的焓變△H和熵變△S自由能變化△G
自由能變化△G綜合考慮了焓變和熵變對體系的影響
△G=△H-T△S
當△G>0時,反應為非自發反應。
當△G<0時,反應為自發反應。
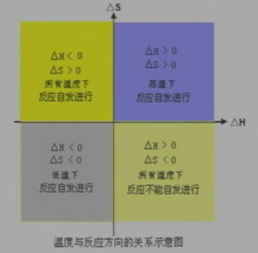
溫度與反應方向的關系示意圖
判斷298K時下列反應能否自發進行
2KClO3(s)=2KCl(s)+3O2(g)
△H=-78.03kJ·mol-1
△S=+494.4J·mol-1·K-1
CaCO3(s)=CaO(s)+CO2(g)
△H(298K)=+178.2kJ·mol-1
△S(298K)=+169.6J·mol-1·K-1
【注意】
1、反應的自發性只能用于判斷反應的方向,不能確定反應是否一定會發生和過程發生的速率。例如涂有防銹漆和未涂防銹漆的鋼制器件,二者發生腐蝕過程的自發性是相同的,但只有后者可以實現。
2、在討論過程的方向時,指的是沒有外界干擾時體系的性質。如果允許外界對體系施加某種作用,就可能出現相反的結果。例如水泵可以把水從低水位升至高水位;高溫高壓下可以使石墨轉化為金剛石,實現的先決條件是要向體系中輸入能量,該過程的本質仍然是非自發性的。
焓減小有利于反應自發,熵增大有利于反應自發。
【課堂達標測試】
1、下列過程是非自發的是( )
A、水由高處向低處流; B、天然氣的燃燒;
C、鐵在潮濕空氣中生銹 D、室溫下水結成冰。
2、碳酸銨[(NH4)2CO3]在室溫下就能自發地分解產生氨氣,對其說法中正確的是( )
A、其分解是因為生成了易揮發的氣體,使體系的熵增大;
B、其分解是因為外界給予了能量;
C、其分解是吸熱反應,據能量判據不能自發分解;
D、碳酸鹽都不穩定,都能自發分解。
3、下列說法正確的是( )
A、凡是放熱反應都是自發的,由于吸熱反應都是非自發的;
B、自發反應一定是熵增大,非自發反應一定是熵減少或不變;
C、自發反應在恰當條件下才能實現;
D、自發反應在任何條件下都能實現。
4、下列說法不正確的是( )
A、焓變是一個與反應能否自發進行有關的因素,多數的能自發進行的反應都是放熱反應。
B、在同一條件下不同物質有不同的熵值,其體系的混亂程度越大,熵值越大。
C、一個反應能否自發進行取決于該反應放熱還是吸熱。
D、一個反應能否自發進行,與焓變和墑變的共同影響有關。
5、以下自發反應可用能量判據來解釋韻是( )
A、硝酸銨自發地溶于水
B、2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol
C、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g);△H=+74.9kJ/mol
D、2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
此內容正在抓緊時間編輯中,請耐心等待
李老師
女,中教中級職稱
熱愛教育,樂于教育,有高尚的師德,事業心強,治學嚴謹,教育教學成績顯著。























