課程內容
《鹽類的水解(1)》
實驗探究
動動手:檢測下列溶液顯酸性、堿性、中性?
(1)CH3COONa (2)Na2CO3
(3)NH4Cl (3)Al2(SO4)3
(5)KNO3
實驗結果統計分析及推理:
測試對象
生成該鹽的
鹽的類型
溶液酸堿性
酸
堿
CH3COONa
CH3COOH
NaOH
強堿弱酸鹽
堿性
Na2CO3
H2CO3
NaOH
堿性
NH4Cl
HCl
NH3·H2O
強酸弱堿鹽
酸性
Al2(SO4)3
H2SO4
Al(OH)3
酸性
KNO3
HNO3
KOH
強酸強堿鹽
中性
討論:CH3COONa的水溶液顯堿性的原因:
(1)寫出醋酸鈉在水溶液中電離的方程式?
(2)寫出水電離的方程式?
(3)CH3COONa溶液中存在著幾種離子?
(4)溶液中哪些離子可以結合成弱電解質?
(5)生成弱電解質時對水的電離平衡有何影響?
醋酸鈉在溶液中的變化:
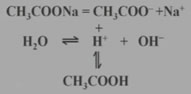
CH3COONa+H2O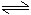 CH3COOH+NaOH
CH3COOH+NaOH
CH3COO-+H2O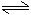 CH3COOH+OH-
CH3COOH+OH-
討論:試從CH4COONa的水溶液顯堿性的原因分析:
為什么NH4Cl的水溶液顯酸性?
氯化銨在溶液中的變化:
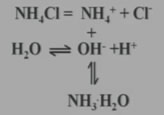
NH4Cl+H2O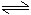 NH3·H2O+HCl
NH3·H2O+HCl
NH4++H2O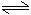 NH3·H2O+H+
NH3·H2O+H+
一、鹽類的水解
在溶液中鹽電離出來的離子跟水所電離出來的H+或OH-結合生成弱電解質的反應,叫做鹽類的水解。
對概念的理解
水解的實質:破壞(促進)了水的電離平衡。
水解反應與中和反應的關系:

討論:以NaCl為例,說明強酸和強堿生成的鹽能否水解?
規律:
有弱才水解
都弱都水解
越弱越水解
誰強顯誰性
書寫水解離子方程式的注意點:
CH3COO-+H2O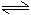 CH3COOH+OH-
CH3COOH+OH-
NH4++H2O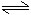 NH3·H2O+H+
NH3·H2O+H+
書寫水解離子方程式的注意點:(一般情況下)
(1)鹽類水解的程度較小,用可逆號“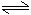 ”表示。
”表示。
(2)鹽類水解的產物很少,不會產生氣體或沉淀,不標“↓”或“↑”。
(3)不把生成物(如H2CO3等)寫成其分解產物的形式。
練習
1、下列離子在水溶液中不會發生水解的是( )
A、NH4+ B、SO42- C、Al3+ D、F-
2、下列溶液PH小于7的是( )
A、溴化鉀 B、硫酸銅
C、硫化鈉 D、硝酸鋇
3、下列溶液能使石蕊指示劑顯紅色的是( )
A、碳酸鉀 B、硫酸氫鈉
C、硫酸鈉 D、氯化鐵
此內容正在抓緊時間編輯中,請耐心等待
劉老師
女,中教高級職稱
優秀教師,豐富的教學實踐經驗,所帶過的學生進步非常大,深受學生的喜歡和家長的好評。























