課程內容
《電解池(1)》
思考:
1、通電前,氯化銅溶液中有哪些離子?如何運動?通電后,陰、陽離子的運動有改變嗎?
2、當離子定向移動到電極表面時,發生的是什么類型的反應?寫出兩電極反應和總的化學方程式。
3、通電后,回路中離子及電子的運動方向怎樣?
實驗微觀解釋
①通電前:CuCl2=Cu2++2Cl-,Cu2+、Cl-為自由移動的離子;
通電后:Cu2+移向陰極得到電子,Cl-移向陽極失去電子;
②電極反應:
陽極:2Cl--2e-=Cl2↑(氧化反應)
陰極:Cu2++2e-=Cu(還原反應)
電解
總反應式:CuCl2====Cu+Cl2↑
一、電解原理
電解:使電流通過電解質溶液而在陰、陽兩極引起氧化還原反應的過程。
①電流是發生反應的動力(使不能自發進行的反應順利進行)。
②陰陽離子做定向移動的導電過程,也就是兩極發生氧化還原的過程,即電解質溶液的導電過程即為電解過程。
③電流是直流電。
④在電解過程中電能轉化為化學能。
二、電解池:
1、定義:電能轉化為化學能的裝置
2、形成電解池的條件:
(1)與電源相連的兩個電極
(2)電解質溶液或熔化電解質
(3)形成閉合回路
3、電極名稱:
陰極:與電源負極相連,進電子,還原反應
陽極:與電源正極相連,出電子,氧化反應
4、電極材科
惰性電極:C、Pt、Au不發生反應
活性電極:Ag及以前金屬,作陽極則溶解
5、電解時離子放電順序
陽離子得到電子或陰離子失去電子使離子電荷降低的過程叫做放電。
①陰極:陽離子放電,金屬活動順序的反順序
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+
注意(一)Fe3+>Cu2+;(二)電鍍時:受離子濃度影響Ag+>Hg2+>Fe3+>Cu2+>Pb2+>Fe2+>Zn2+>H+
②陽極:活性電極(Ag以前),電極失電子
惰性電極(Pt、Au、石墨),陰離子放電S2->I->Br->Cl->OH->含氧酸根>F-
6、電解時電極反應式、總反應式
陽極:2Cl--2e-=Cl2↑
陰極:2H++2e-=H2↑
2H2O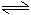 2H++2OH-
2H++2OH-
總反應:
通電
2H2O+2Cl-====H2↑+Cl2↑+2OH-
注意:
(1)得失電子數目一致。
(2)兩極放電的H+或OH-來源于水時,總反應的反應物書寫水分子。
(3)注明條件“通電”。
書寫電解硫酸銅溶液的電極反應式和總反應式
陰極:2Cu2++4e-=2Cu
陽極:4OH--4e-=2H2O+O2↑
4H2O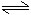 4H++4OH-
4H++4OH-
總反應: 通電
2Cu2++2H2O====2Cu+4H++O2↑
練習
(1)寫出以碳棒作電極電解飽和氯化鈉溶液的電極反應式。
(2)寫出以銅棒作電極電解氯化銅溶液的電極反應式。
7、用惰性電極電解電解質溶液的規律
電解水型:含氧酸、強堿、活潑金屬的含氧酸鹽(如NaOH、H2SO4、K2SO4)的電解。
電解電解質型:無氧酸、不活潑金屬的無氧酸鹽(如HCl、CuCl2)溶液的電解。
電解質和水同時被電解型:
A、放氫生堿型:活潑金屬的無氧酸鹽(如NaCl)溶液的電解
B、放氧生酸型:不活潑金屬的含氧酸鹽(如CuSO4、AgNO3)溶液的電解
電解池與原電池的區別:
電解池
原電池
能量轉換
電能轉化為化學能
化學能轉化為電能
離子的遷移方向
陽離子向陰極遷移,陰離子向陽極遷移
陽離子向正極遷移,陰離子向負極遷移
發生氧化反應的電極
陽極(接電源正極)
負極
發生還原反應的電極
陰極(接電源負極)
正極
此內容正在抓緊時間編輯中,請耐心等待
劉老師
女,中教高級職稱
優秀教師,豐富的教學實踐經驗,所帶過的學生進步非常大,深受學生的喜歡和家長的好評。























